医药研发服务行业发展趋势及主要玩家(附报告目录)
1、全球医药研发投入不断增长
由于已有药品专利陆续到期以及研发产品线的后期成果稀缺,全球各大制药公司为避免未来业务发展的困境,一直在药品研发中投入大量的资金。2008年全球金融危机之后,全球范围内主要化学制药和生物制药公司依然在研发领域投入了较大规模的资金。随着经济发展、人口老龄化加剧以及卫生健康意识增强等多因素影响,全球药物研发投入也逐渐升温。
美国不仅是全球第一大医药市场,就研发实力来看,美国的医药研发水平也走在世界前列。2020 年,美国前十大制药企业研发支出合计高达 622.72 亿美元,占合计营业收入的比重为 20.81%。
相关报告:北京普华有策信息咨询有限公司《2021-2027年医药外包行业细分市场调查及前景预测报告》
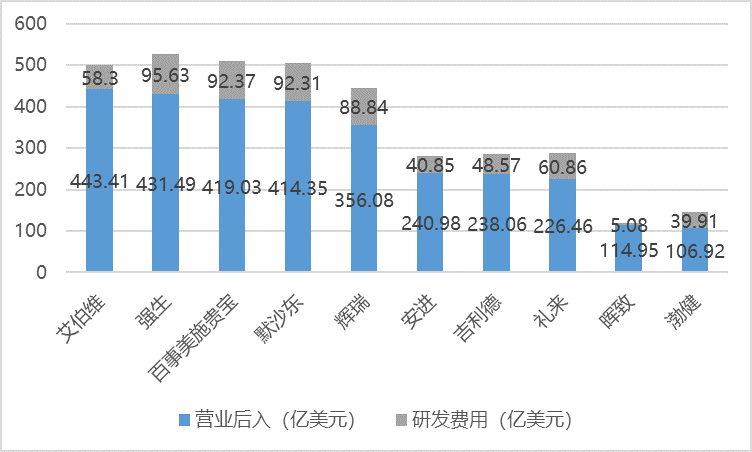
资料来源:普华有策
2、我国医药研发服务行业现状
(1)政府加大对药物研发支持力度
近年来,我国政府不断加大对药物研发的支持力度。2017 年 12 月,原国家食品药品监督管理总局发布《关于鼓励药品创新实行优先审评审批的意见》,对创新药和临床急需用药进行优先审评审批,将减少其排队时间、提高研发效率、加快上市。
2018 年 5 月,国家发改委、工信部、卫健委及国家药监局联合下发了《关于组织实施生物医药合同研发和生产服务平台建设专项的通知》,拟于“十三五”期间组织实施生物医药合同研发和生产服务平台建设专项,将支持医药研发生产服务行业的发展,打造一批综合实力强、具有国际竞争力的专业化合同研发和生产服务企业,为药品上市许可持有人制度的全面实施铺平道路,这将直接利好医药研发生产服务行业的发展。
2020 年 2 月,国务院发布了《关于深化医疗保障制度改革的意见》,要求做好仿制药质量和疗效一致性评价受理与审评,通过完善医保支付标准和药品招标采购机制,支持优质仿制药研发和使用,促进仿制药替代;增强医药服务可及性,协同推进医药服务供给侧改革。
(2)国内药品监管政策逐步与国际接轨
2017 年 6 月,原国家食品药品监督管理总局(CFDA)加入国际人用药品注册技术协调会(ICH),成为 ICH 的全球第 8 个监管机构成员。2018 年 6月,新组建的国家药品监督管理局进一步成为 ICH 管理委员会成员。加入ICH,意味着我国的药品监管部门、制药行业和研发机构逐步转化和实施国际最高技术标准和指南,并积极参与规则制定,进一步提高新药研发、注册、上市的效率,中国国际多中心临床试验项目有望大幅增长,国际多中心临床试验的实施可以加快新药同步研发,使试验结果用于多个监管机构注册审评时维持试验设计在相同水平的科学严谨性,还可以优化宝贵的患者资源使用和减少不必要的研发费用。我国药品监管政策与国际接轨,将有利于 CRO 行业长远发展,也是提升制药创新能力和国际竞争力的重大机遇。
(3)药物研发投入规模持续提升
在新一轮药政改革的背景下,我国医药行业研发投入增幅较快,国内医药企业研发投入保持了较高的增幅水平。统计数据显示,2014 年我国医药研发投入为 93 亿美元,2018 年增长至 174 亿美元,年均复合增长率约为17.0%,2020 年我国医药行业研发投入将达到 270 亿美元。2020 年国内 CRO 市场规模 83 亿美元,其中临床 CRO 市场规模 60 亿美元,临床前 CRO 市场规模23 亿美元,预期未来 3 年复合增速 27.49%,高于全球增速水平。随着“重大新药创制”科技重大专项、鼓励优质仿制药研发等一系列国家政策的推出和实施,未来我国药物研发的资金投入规模仍将继续提升。药物研发投入的持续增长是我国 CRO 行业近年来高速发展的基础。
我国医药行业研发投入的不断增长,以及国内行业政策的大力扶持,使得CRO 行业在我国得到了长足的发展。
(4)化药注册申请数量稳步提升
MAH 制度于 2015 年起推出后,极大地促进我国医药行业的技术创新和质量体系的提高。对于研发机构来说,在 MAH 制度下可以作为上市许可持有人持有药品批准文号,分别委托药品生产企业进行生产和销售企业进行销售,从而获得直接收益,增强企业研发动力,驱动研发人员创新积极性。此外,在MAH 制度下,如果不含技术审评时间,新药临床申报可由之前的 117-127 天缩短至 14 天;若包含技术审评时间,则由原先的 12-18 个月缩短至 9.5 个月,大幅度加速了新药的上市进程。在此大环境下,研发机构需要建立完整合理的质量管理体系和药品安全监测体系,积极采取开放式合作模式,同 CRO 研究机构积极合作降低新药研发成本和分散风险。
从 ANDA 的申报情况上看,2011 年-2015 年 CDE 收到 ANDA 申请均在2,000 次以上,2016 年以来由于《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发(2016)8 号)等一系列政策的出台,ANDA 申请规模缩减的同时一致性评价申请数量快速增长,2020 年 CDE 受理一致性评价申请 914 件,件数较 2018 年增长 50.58%。随着各项政策的出台,对仿制药研发过程中一致性评价的要求不断提高,使得高端仿制药研发成为 CRO 行业新的增长点。
仿制药一致性评价包括药学一致性评价、BE 试验等过程。对绝大部分口服制剂和复杂注射剂而言,BE 试验是否等效是检验其有效性和安全性的关键。根据 药品审评中心(CDE )公示的数据,中国 BE 试验数量 2020 年达到了 1,117 个。2015 年以前,BE 试验仅维持慢增长趋势,由于一致性评价推动,自此试验数量每年大幅增加。从 2015 年至 2020 年,中国 BE 试验年度数量从 136 个上升至 1,117 个,增幅远超整体临床试验。
3、CRO 产业发展趋势
(1)从“单一外包”逐渐向长期合作模式转变
随着 CRO 企业渗透率的不断提升,制药企业与 CRO 企业间合作关系持续改变,在研发过程中,药企与 CRO 企业不断深入地合作与探讨,建立了较为良好的互信关系,双方互相渗透互相影响,职能边缘变得模糊。CRO 企业实现了与药企的深度绑定,大型 CRO 企业开始尝试风险共担模式,该模式使得 CRO企业可以在总体风险可控的前提下大大提高收入,可以在药品上市后获得一定比例的销售收入或者利润分成。
(2)仿制药一致性评价常态化
2020 年 5 月,国家药品监督管理局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》,指出“已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报”,注射剂一致性评价开始提速,未来我国仿制药一致性评价将逐步进入常态化。
一致性评价政策加速落地后,一方面,仿制药一致性评价需求将进一步增长,CRO 行业有望加强高端仿制药研发服务,借助特色化、差异化服务进一步提高市场份额;另一方面,在“带量采购”政策的催化下,创新药研发的需求将进一步提升,CRO 企业将加快向创新药研发服务布局,并进一步向综合型CRO 服务商转变。
(3)业务纵向一体化
新药研发是一个系统化工程,对应的 CRO 服务类型覆盖了化学结构分析、化合物活性筛选、药理学、药效学、药代动力学、药物安全性评价、药物配方、药物基因组学、原料药及制剂研究、I 至 IV 期临床试验的设计、生物等效性试验研究者和试验单位的选择、监查、稽查、数据管理、统计分析以及注册申报等工作等多个环节,不同环节对应的技术难度不同,可获得的附加值也有所差异。目前,国内大多数 CRO 企业通常专注于某一或部分细分领域,提供覆盖全产业链的一站式 CRO 服务的企业较少,而在欧美发达国家,大型跨国CRO 企业通过不断并购与合作拓展核心业务,积极往一站式 CRO 服务发展,其服务基本可涵盖医药研发整个阶段。
随着药企对研发外包的需求不断提升,追求一站式服务的需求加大,CRO企业实行纵向一体化发展成为构建自身竞争力、提升盈利能力的有效途径。相比于业务单一的 CRO 企业,高标准、业务全产业链覆盖的 CRO 企业更能满足制药企业多方面的需求,通过与现有客户的紧密合作关系,进一步承接与客户现有项目相关的其他研究与外包工作,从而打开产业链某单一阶段市场的天花板,并与客户进入到更深层次的合作中,进一步提升客户忠诚度。
未来,通过在 CRO 行业各细分领域内拓展业务范围从而实现产业链的上下游延伸与纵向一体化,将成为 CRO 行业新的发展趋势,CRO 企业将逐步打造完整的产业服务链,满足客户整体研发外包需求。
(4)临床数据管理信息化
临床实验数据采集和管理会直接影响临床试验的质量。信息化水平的提升可以有效减少药物研发的时间,缩短新药上市的流程,目前多数 CRO 企业使用的是 TMF 模式对临床试验数据进行管理,即使用纸质形式对临床数据进行提交或简单的文件传输,限制了操作人员对试验进行实时的访问。
近年来,CRO 逐步由传统的纸质化的临床数据采集和数据管理模式转向电子化的临床数据采集和数据管理。随着大数据、物联网及智能可穿戴设备的发展,CRO 企业开始尝试通过可穿戴设备、医疗器械装备等进行患者招募、远程收集参与者的临床数据、活动数据和关键的生物指标,减少随访及跟踪次数,结合电子化的临床数据采集和数据管理可大大而提升效率,降低临床试验成本。
4、行业内主要企业竞争情况概述
我国本土 CRO 企业数量众多,但大多数的临床试验外包服务类型单一,未能形成规模和核心竞争力,在市场规模、业务范围、行业认知度等方面均与跨国 CRO 企业存在一定的差距。目前,国内 CRO 企业中,药明康德、康龙化成具有全方位、一体化的医药研发服务能力,在药物发现、药学研究、临床试验、药物工艺研发和生产领域占据行业的领先地位。
泰格医药、博济医药、百花村、诺思格、阳光诺和、百诚医药等企业通过不断提升技术实力和服务质量,在市场上获得了良好的口碑,不断抢占医药研发服务细分领域的市场份额,逐步成为中国 CRO 行业的中坚力量。
(1)泰格医药
泰格医药(股票代码 300347.SZ)成立于 2004 年,是国内领先的临床合同研究组织,专注于为医药产品研发提供临床试验、数据管理与生物科技、注册申报等全方位服务。2020 年,泰格医药的营业收入为 319,227.85 万元,净利润为 202,900.07 万元。
(2)诺思格
公司是专业的临床试验外包服务提供商,主营业务包括临床试验运营服务、临床试验现场管理服务、生物样本检测服务、数据管理与统计分析服务、临床试验咨询服务、临床药理学服务等。2020 年实现营业收入 48,444.97 万元,净利润 8,529.24 万元。
(3)阳光诺和
阳光诺和成立于 2009 年,是国内较早对外提供药物研发服务的 CRO 企业,公司提供的服务主要包括药学研究、临床试验和生物分析。2020 年实现营业收入 34,735.64 万元,净利润 7,416.26 万元。
(4)万邦医药
公司成立于 2006 年,是一家同时提供药学研究和临床研究服务的综合型 CRO 企业,通过合同形式为医药企业和其他医药研发机构提供专业化医药研发外包服务。2020年公司营业收入13,912.99万元,净利润5,451.56万元。
(5)百诚医药
百诚医药是一家以药学研究为核心的综合性医药技术研发企业,采取“受托研发服务+研发技术成果转化”双线发展战略,主要为各类制药企业、医药研发投资企业提供药物研发服务及研发技术成果转化。2020 年实现营业收入20,724.78 万元,净利润 5,719.35 万元。
(6)博济医药
博济医药(股票代码 300404.SZ)成立于 2002 年,主要提供药物临床试验、药学研究、临床前研究、技术成果转化服务等。2020 年,博济医药实现营业收入 26,046.84 万元,净利润 2,486.83 万元。
(7)百花村
百花村(股票代码 600721.SH)成立于 1996 年,是中国领先的高端药物研发企业,面向医药行业提供药物发现、研究、注册等专业技术服务。2020 年,百花村的营业收入为 8,453.04 万元,净利润为-31,976.45 万元。